
jueves, 1 de septiembre de 2016
domingo, 14 de agosto de 2016
APORTES DE LAS CIVILIZACIONES PREHISPÁNICAS DE AMÉRICA
APORTES DE LAS CIVILIZACIONES PREHISPÁNICAS DE AMÉRICA

Antes de la llegada de los españoles, América estuvo poblada por indígenas, pero no todos los pueblos alcanzaron la categoría de civilizaciones. Sin embargo, se reconoce a los mayas, los chibchas, los aztecas y los incas como verdaderos imperios.
En la actualidad existe interés por descubrir, valorar y comprender a estas grandes culturas, para ello, los historiadores y antropólogos agrupan a las diferentes civilizaciones en periodos de evolución histórica y cultural.
Algunos legados que aún conservamos son: la numeración, el calendario, el arte, el lenguaje, patrimonios culturales, sistemas agrícolas, aportes en la medicina natural, artesanía, alimentación y otros.

Desde el punto de vista agrícola, las formas de cultivo prehispánicas provocaron un gran éxito en cuanto a sus cultivos básicos. En cuanto a la agricultura, los pueblos precolombinos aportaron cultivos y productos como:
Maíz, Frijol, Cacao (y su uso como chocolate) Aguacate (palta) Cacahuate (maní) Amaranto, Vainilla, Jitomate (xiltomatl), Jitomate huaje(miltomatl) Chile (ají) Calabaza, Papa, Ejote, Chilacayote, Camote, Chayote, Yuca (pan de casabe) Chirimoya, Piña, Papaya, Chirimoya, Guayaba, Mamey, Zapote (el uso del chicle natural extraido del árbol,como parte del aseo bucal) Anonas,Tejocote, Capulín, Achiote, Epazote, Tabaco (y su uso envuelto en hojas de maíz o en pipas de diversos materiales) Henequén (el uso de las fibras) gran variedad de colorantes naturales, entre los más importantes, el añil, el palo de tinte y la grana cochinilla (que se alimenta de una de las tantas especies de nopal).
Los aportes culturales son innumerables, pero te menciono los más relevantes que quedaron en textos de dos naciones que se destacaron dado que tenían formas de escritura con las que dejaron plasmado su pensamiento y filosofía, los mexicas/aztecas y los mayas.
La poesía nahuatl era un arte muy apreciado, uno de sus principales representantes fue Nezahoalcoyotl.
Los libros de la literatura maya que se conocen, son de temas religiosos y mitológicos y no son de fácil interpretación. Hacen continua alusión a su historia, su religión y la ciencia de su época, con un profundo sentido patriótico y poético.
La concepción del cero (cero) en la numeración y el registro del tiempo. Los calendarios indígenas, particularmente el maya con un nivel de exactitud mayor que el de los calendarios contemporaneos.
La herbolaria prehispánica fue entendida por los européos como una valiosa aportación a la medicina. El Códice Badiano, es considerado la mayor recopilación de medicina herbolaria prehispánica.
La ingeniería constructiva e hidráulica indígena, resultó sorprendente para los européos, la creación de ciudades perfectamente urbanizadas, edificios monumentales y profusa creación artística integrada a su arquitectura.
En cuestiones de lenguaje, el español hablado actualmente en el continente, está fuertemente influido por palabras de las lenguas aborígenes que habitaron las distintas regiones, aportando términos y costumbres que reflejan la profunda cultura que si bien, fue sometida por el conquistador, mantuvo muchas de sus características esenciales.
jueves, 11 de agosto de 2016
Digestión intracelular
La digestión intracelular, es un tipo de nutrición heterótrofa en el cual el alimento es descompuesto (generalmente por enzimas) y procesado en el interior de la célula. Es propio generalmente de organismos muy simples y unicelulares como lo es la ameba.
Los protistas y las esponjas realizan una digestión intracelular, en la cual ingieren partículas alimentarias microscópicas. Una vez digeridos, los alimentos quedan en una vacuola digestiva; después la vacuola se fusiona con enzimas digestivas y el alimento es fragmentado en moléculas más pequeñas que pueden absorberse dentro del citoplasma de la célula. Los restos no digeridos permanecen dentro de la vacuola, la cual, finalmente, los expulsa al exterior de la célula.
En la eucariota consiste en digerir los nutrientes dentro de la célula, utilizando las enzimas digestivas de los lisosomas, es decir por fagocitosis y las engloban formando vesículas digestivas.Los nutrientes que obtienen pasan al citoplasma y los alimentos no digeridos son expulsados al exterior.Éste es el único sistema del que disponen animales poco evolucionados para digerir su alimento.
Digestión intracelular: La célula ingiere el alimento y lo engloban por medio de los seudópodos. Los lisosomas vierten enzimas digestivas en la vacuola. La digestión acaba cuando la materia orgánica pasa al citoplasma.
jueves, 28 de julio de 2016
Tejidos vegetales | ||
Los tejidos vegetales están formados por células eucariotas de tipo vegetal, cuyas diferencias con las células animales han sido estudiadas en el apartado 1 de este bloque.
Las células vegetales que constituyen las plantas pueden ser : Células vivas: encargadas del crecimiento de la planta, fotosíntesis, respiración, almacenamiento de sustancias y reparación de daños. |  | |
Células muertas: sus paredes celulares engrosadas y lignificadas proporcionan soporte y resistencia a la planta y forman vasos conductores para la savia bruta.
Los tejidos celulares se pueden clasificar en dos grandes grupos: |  | |
A- Embrionarios o Meristemáticos: Sus células poseen la capacidad de dividirse. Son células pequeñas, muy poco especializadas, de pared celular delgada, con vacuolas pequeñas y núcleos grandes. Pueden ser de dos tipos. a.1. Meristemos primarios: Responsables del crecimiento del embrión en la semilla y del crecimiento en longitud de la planta. Se localizan en la raiz y en las yemas del tallo (apicales en el extremo y axilares como base de futuras hojas y ramas). | 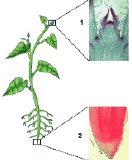 | |
a.2. Meristemos secundarios:
Sus células proceden de otras células adultas que recuperan temporalmente la capacidad de reproducirse. Responsables del crecimiento en grosor de la planta y de formar nuevos vasos conductores. B. Permanentes o definitivos: Están compuestos por células que ya no se pueden dividir aunque, como hemos visto, en algunos casos (agresión mecánica o por el fuego) pueden recuperar temporalmente esa actividad. Distintos tipos de estos tejidos se agrupan en Sistemas, que se extienden por todas las partes de la planta. | 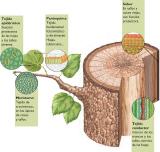 | |
jueves, 7 de julio de 2016
Una reacción química consiste en el cambio de una o mas sustancias en otra(s). Los reactantes son las sustancias involucradas al inicio de la reacción y los productos son las sustancias que resultan de la transformación. En una ecuación química que describe una reacción, los reactantes, representados por sus fórmulas o símbolos, se ubican a la izquierda de una flecha; y posterior a la flecha, se escriben los productos, igualmente simbolizados. En una ecuación se puede indicar los estados físicos de las sustancias involucradas de la manera siguiente: (s) para sólido, (l) para líquido, (g) para gaseoso y (ac) para soluciones acuosas. Los catalizadores, temperaturas o condiciones especiales deben especificarse encima de la flecha.
Ecuación Química: representa la transformación de sustancias.
Reactante(s) à Producto(s)
|
Tipos de Reacciones Químicas
Las reacciones químicas pueden clasificarse de manera sencilla en cinco grandes grupos. Existen otras clasificaciones, pero para predicción de los productos de una reacción, esta clasificación es la más útil.
Reacciones de Síntesis o Composición
En estas reacciones, dos o más elementos o compuestos se combinan, resultando en un solo producto.
Síntesis Química: la combinación de dos o mas sustancias para formar un solo compuesto.
A + B à C
(donde A y B pueden ser elementos o compuestos)
|
Ejemplo:
Escriba la reacción de síntesis entre el aluminio y el oxígeno.
Solución:
Dos elementos se combinarán para formar el compuesto binario correspondiente. En este caso, el aluminio y el oxígeno formarán el óxido de aluminio. La ecuación que representa la reacción es la siguiente:
4 Al (s) + 3 O2 (g) à 2 Al2O3 (s)
Nota: Es importante recordar los elementos que son diatómicos, los cuales se escriben con un subíndice de 2 cuando no se encuentran combinados y participan en una reacción. Estos son el hidrógeno, nitrógeno, oxígeno, flúor, cloro, bromo y el yodo.
Estas reacciones son inversas a la síntesis y son aquellas en la cuales se forman dos o más productos a partir de un solo reactante, usualmente con la ayuda del calor o la electricidad.
Descomposición Química: la formación de dos o mas sustancias a partir de un solo compuesto.
A à B + C
(donde B y C pueden ser elementos o compuestos)
|
Ejemplo:
Escriba la ecuación que representa la descomposición del óxido de mercurio (II).
Solución:
Un compuesto binario se descompone en los elementos que lo conforman. En este caso, el óxido de mercurio (II) se descompone para formar los elementos mercurio y oxígeno. La ecuación que representa la reacción es la siguiente:
2 HgO (s) à 2 Hg (l) + O2 (g)
Estas reacciones son aquellas en las cuales un átomo toma el lugar de otro similar pero menos activo en un compuesto. En general, los metales reemplazan metales (o al hidrógeno de un ácido) y los no metales reemplazan no metales. La actividad de los metales es la siguiente, en orden de mayor actividad a menor actividad: Li, K, Na, Ba, Ca, Mg, Al, Zn, Fe, Cd, Ni, Sn, Pb, (H), Cu, Hg, Ag, Au. El orden de actividad de los no metales mas comunes es el siguiente: F, O, Cl, Br, I, siendo el flúor el más activo.
Desplazamiento Químico: un elemento reemplaza a otro similar y menos activo en un compuesto.
AB + C à CB + A ó AB + C à AC + B
(dónde C es un elemento más activo que un metal A o un no metal B)
|
Ejemplo 1:
Escriba la reacción entre el magnesio y una solución de sulfato de cobre (II).
Solución:
El magnesio es un metal más activo que el cobre y por tanto, lo reemplazará en el compuesto, formando sulfato de magnesio. A la vez, el cobre queda en su estado libre como otro producto de la reacción. La ecuación que representa la reacción es la siguiente:
Mg (s) + CuSO4 (ac) à MgSO4 (ac) + Cu (s)
Ejemplo 2:
Escriba la reacción entre el óxido de sodio y el flúor.
Solución:
El flúor es un no metal más activo que el oxígeno y por tanto, lo reemplazará en el compuesto, formando fluoruro de sodio. A la vez, el oxígeno queda en su estado libre como otro producto de la reacción. La ecuación que representa la reacción es la siguiente:
2 F2 (g) + 2 Na2O (ac) à 4 NaF (ac) + O2 (g)
Ejemplo 3:
Escriba la reacción entre la plata y una solución de nitrato de bario.
Solución:
La reacción no se da, puesto que la plata es un metal menos activo que el bario y por ende, no lo reemplaza.
Estas reacciones son aquellas en las cuales el ión positivo (catión) de un compuesto se combina con el ión negativo (anión) del otro y viceversa, habiendo así un intercambio de átomos entre los reactantes. En general, estas reacciones ocurren en solución, es decir, que al menos uno de los reactantes debe estar en solución acuosa.
Doble Desplazamiento Químico: los reactantes intercambian átomos – el catión de uno se combina con el anión del otro y viceversa.
AB + CD à AD + CB
|
Solución:
En esta reacción, la plata reemplaza al hidrógeno del ácido, formando cloruro de plata. Al mismo tiempo, el hidrógeno reemplaza a la plata, formando ácido nítrico con el nitrato. La ecuación que representa la reacción es la siguiente:
AgNO3 (ac) + HCl (ac) à HNO3 (ac) + AgCl (s)
Reacciones de Neutralización
Estas reacciones son de doble desplazamiento o intercambio. Su particularidad es que ocurren entre un ácido y una base y los productos de la reacción son agua y una sal formada por el catión de la base y el anión del ácido.
Por ejemplo, la reacción entre el ácido sulfúrico y el hidróxido de sodio resulta en la formación de agua y sulfato de sodio. La ecuación que representa esta reacción es la siguiente:
H2SO4 (ac) + 2 NaOH (ac) à 2 H2O (l) + Na2SO4 (ac)
Estas reacciones ocurren cuando un hidrocarburo orgánico (un compuesto que contiene carbono e hidrógeno) se combina con el oxígeno, formando agua y dióxido de carbono como productos de la reacción y liberando grandes cantidades de energía. Las reacciones de combustión son esenciales para la vida, ya que la respiración celular es una de ellas.
Combustión: un hidrocarburo orgánico reacciona con el oxígeno para producir agua y dióxido de carbono.
hidrocarburo + O2 à H2O + CO2
|
Ejemplo 1:
Escriba la ecuación que representa la reacción de combustión de la glucosa, el azúcar sanguíneo (C6H12O6).
Solución:
En esta reacción, la glucosa es un hidrocarburo que reacciona con el oxígeno, resultando en los productos de la combustión – el agua y el dióxido de carbono. La ecuación que representa la reacción es la siguiente:
C6H12O6 + O2 à H2O + CO2
jueves, 30 de junio de 2016
de divertidos, nos explican conceptos básicos de física y química.
Tal como versa la 'Sinfonía de la ciencia': La ciencia es la poesía de la realidad. Así, encontramos fenómenos que nos llevan a compararlos con la magia por sus efectos inmediatos y espectaculares; aunque propiamente todo lo que nos rodea tiene su base en la misma naturaleza, solo que a veces se manifiesta de forma queda y constante, pero no por esto menos asombrosa.
Veamos algunos ejemplos sencillos de experimentos caseros que resultan “trucos” entretenidos y divertidos, que, además, tienen su explicación científica no menos genial.
El agua que se congela al instante
Para este experimento es necesario cuidar el tiempo en el que nuestros refrigeradores enfrían el agua un poco antes de cambiar de estado a sólido. Podemos ver en el video que las botellas se retiran del congelador y el agua aún está líquida, pero al aplicar un estímulo como un golpe en la botella genera la energía que se acumula y desencadena la cristalización de todo el agua. Así mismo, al vaciarla en un recipiente con hielo, el chorro de agua se cristaliza ante nuestra mirada. Este experimento también se puede hacer con refrescos de soda, el comportamiento del líquido es el mismo, lo que variará será el tiempo de refrigeración para conseguir la temperatura adecuada.
Hacer fuego con una botella de agua
Con un tanto de paciencia y un mucho de encontrar el truco es posible que te puedas convertir en un hacedor de fuego con un el instrumento menos esperado: una botella plástica llena de agua, de preferencia que tenga una de sus partes curvadas, será suficiente. Ésta hará las veces de un lente que, al atravesar la luz solar por él, se pueden dirigir y concentrar en un sólo punto, si la superficie a la que va dirigido el rayo de luz se calienta lo suficiente que logra laignición.
Lodo mágico de papas
Este alocado resultado con un procedimiento sencillo nos da para muchos ratos de entretenimiento. Cuando remojamos las papas picadas, y por el proceso dedecantación, vemos como el almidón de estas se va al fondo del frasco (sedimentación). Los varios pasos que se proponen el video sólo sirven para dejar libre de grumos y partes de la cáscara que pudiera haber en la mezcla. El almidón de papa contiene fosfato enlazado a él, lo que incremente la viscosidad.
No solamente se puede hacer con almidón de papa, otros polvos como la harina de maíz sirven para el mismo propósito. El agua quinada que se le agrega al final del procedimiento brilla bajo luz ultravioleta (luz negra) debido a la fluorescencia natural del sulfato de quinina presente en ella, así, nos da un fantástico resultado y un comportamiento muy interesante de la mezcla.
jueves, 16 de junio de 2016
En química, un compuesto es una sustancia formada por la combinación de dos o máselementos de la tabla periódica.1 Los compuestos son representados por una fórmula química. Por ejemplo, el agua (H2O) está constituida por dos átomos de hidrógeno y uno de oxígeno.
Los compuestos tienen propiedades intrínsecas (ver valencia) y ciertas características como; una composición constante y componentes que siempre están en proporciones constantes. Están formados por moléculas o iones con enlaces estables que no obedece a una selección humana arbitraria. Por lo tanto, no son mezclas o aleacionescomo el bronce o el chocolate.2 3
Finalmente, los elementos de un compuesto no se pueden dividir o separar por procesos físicos (decantación, filtración, destilación), sino solo mediante procesos químicos.
jueves, 2 de junio de 2016
Principio de Pascal

El funcionamiento de la prensa hidráulica ilustra el principio de Pascal
En física, el principio de Pascal o ley de Pascal, es una ley enunciada por el físico-matemático francés Blaise Pascal (1623-1662) que se resume en la frase: la presión ejercida sobre un fluido incompresible y en equilibrio dentro de un recipiente de paredes indeformables se transmite con igual intensidad en todas las direcciones y en todos los puntos del fluido.1
En pocas palabras, se podría resumir aún más, afirmando que toda presión ejercida hacia un fluido, se esparcirá sobre toda la sustancia de manera uniforme.2 El principio de Pascal puede comprobarse utilizando una esfera hueca, perforada en diferentes lugares y provista de un émbolo. Al llenar la esfera con agua y ejercer presión sobre ella mediante el émbolo, se observa que el agua sale por todos los agujeros con la misma velocidad y por lo tanto con la misma presión.
También podemos observar aplicaciones del principio de Pascal en las prensas hidráulicas, en los elevadores hidráulicos, en los frenos hidráulicos y en los puentes hidráulicos.
lunes, 11 de abril de 2016
jueves, 31 de marzo de 2016
jueves, 17 de marzo de 2016
Suscribirse a:
Comentarios (Atom)


